含有抗α4β7抗体的稳定制剂的制作方法-ag尊龙凯时
本发明涉及抗α4β7抗体的皮下制剂,其在室温下至少稳定保存6个月,所述制剂可通过皮下给药治疗适合于用抗α4β7抗体治疗的相关的疾病。
背景技术:
1、单克隆抗体药物是近年来生物制药领域发展最迅速的行业,与化学小分子药物相比,单克隆抗体药物的理化性质较复杂,其稳定性较低,在储存过程中易形成聚集体。理化性质的改变可能造成药物活性剂免疫原性的改变,因此需要针对单克隆抗体药物的特性筛选处方,研制适宜的制剂以保证蛋白类药物的安全性、有效性和稳定性(参见重组单克隆抗体药物制剂处方的作用及相关审评要点,邱晓,罗建辉,中国新药杂志2019年第28卷第16期)。
2、蛋白质制剂应有助于在生产、包装、储存和运输期间保持生物聚合物的稳定性和生物活性,直至最终输送到病人体内的靶部位。
3、传统的抗体药物输送方式有静脉输送、皮下注射、肌肉注射。静脉输送通常是高剂量或多剂量,注射时间比较长,一般需要约90分钟或更长时间,并且静脉输送需要有医务知识的人员协助和前期的准备程序,因此对于患者、医生和医务人员来说都不方便,并且会产生另外的成本。肌肉注射一般因为注射点面积小,会产生副作用如组织硬化、水肿等,所以注射体积不能太大,一般认为不能超过20毫升,注射时间也不能太长。相比之下,皮下注射具有能够立即给予的优点并且便于病人自行给药,但是与静脉内注射相比,吸收率相对较低,并且当注射量为3-5ml或更多时,它可能因为吸收缓慢而在注射部位引起肿胀和疼痛。由于这个原因,皮下注射蛋白质治疗剂通常限于少量的2ml或更少的溶液注射。
4、目前已经上市的抗α4β7抗体主要为。维得利珠单抗作为一种人源化单克隆抗体,与α4β7整合素特异性结合,阻断α4β7整合素与madcam-1相互作用,抑制记忆t淋巴细胞穿过内皮迁移至胃肠道的炎症组织,从而精准抑制肠道炎症,不影响全身性免疫功能。目前市面上已有的维得利珠单抗的制剂形式有300mg的静脉给药剂型,一般情况是在0、2和6周时,历时约30分钟静脉输注300mg,而后每8周一次。所以,依据患者需求,亟需要开发一种能可以用于皮下注射、显著降低注射时间的、方便患者的新制剂。
技术实现思路
1、本发明要解决的问题是提供包含高浓度的抗α4β7抗体、可以皮下注射、单次注射药量满足病人需求且显著降低注射时间的稳定的药物制剂。
2、皮下注射是经典的微量体积注射方式,注射液必须经由皮肤间质进入作用靶点,而这种由胶原蛋白、弹性蛋白、纤维连接蛋白和透明质酸(hyaluronic acid,ha)等结构性大分子组成的皮肤间质,具有复杂的三维立体结构,限制了皮下注射的扩散速率和输液量。本发明人出乎意料地发现本发明的抗α4β7抗体和透明质酸酶可以形成稳定的制剂,且透明质酸酶的存在不影响本发明抗体的活性,所述稳定的制剂能够实现以更高的体积进行皮下注射。首先,高浓度的抗体制剂的制备是有挑战性的,较高浓度的蛋白会有很大的粘性,增加了聚集的风险;其次,加入透明质酸酶且能保持高浓度的抗体,并达到一定的稳定性,是非常困难的。并且,虽然抗体具有非常相似的总体结构,但抗体在氨基酸组成和糖基化方面有所不同,每种抗体具有不同的聚集行为,所以针对某种抗体获得稳定的制剂,特别是获得同时含有透明质酸酶的制剂没有规律可循。
3、而本发明出乎意料的获得了一种包含高浓度的抗α4β7抗体的、稳定的药物制剂,其可以用于皮下注射,单次剂量满足病人需要的剂量且显著降低注射时间。
4、本发明第一方面提供了一种包含抗α4β7抗体的药物制剂,它包含如下成分:
5、i.抗α4β7抗体;和
6、ii.透明质酸酶。
7、可选地,所述α4β7抗体包含seq id no:1、seq id no:2、seq id no:3的重链cdr1、cdr2、cdr3和包含seq id no:4、seq id no:5、seq id no:6的轻链cdr1、cdr2、cdr3。
8、可选地,所述α4β7抗体包含seq id no:7的重链可变区和seq idno:8的轻链可变区。
9、所述药物制剂,其进一步包含
10、i.缓冲液;和/或
11、ii.表面活性剂;和/或
12、iii.稳定剂;和/或
13、iv.粘度下降剂;和/或
14、v.抗氧化剂;
15、所述制剂具有约4.0-约7.0的ph。
16、可选地,所述抗α4β7抗体的浓度为:
17、约25mg/ml-约300mg/ml,优选为约50mg/ml-约250mg/ml,优选为约50mg/ml-约170mg/ml,更优选为约50mg/ml,约100mg/ml,约120mg/ml,约150mg/ml,约160mg/ml,约170mg/ml。
18、可选地,所述透明质酸酶为自重组dna技术制造、人样品衍生或者动物组织提取,优选为重组dna技术制造的人源化重组透明质酸酶rhuph20(seq id no:9)。
19、可选地,所述透明质酸酶的浓度为约1000u/ml-约20000u/ml,优选为约1000u/ml-约10000u/ml。
20、透明质酸酶是一种降解透明质酸并降低细胞外基质中透明质酸的粘度从而增加组织渗透性的酶。透明质酸酶(包括rhuph20)的酶活性可由单位/ml(u/ml)或由特定制剂中的总酶活(u)来定义,如下文进一步所解释。
21、一个单位的酶活性(u)的标准定义是每单位时间催化限定量的底物反应的酶量,例如一摩尔或一纳摩尔底物/分钟。用于测定透明质酸酶制剂活性的技术在本领域中是已知的,并且透明质酸酶的活性通常以usp单位或单位表示,下文均用“u/ml”表示透明质酸酶的活性。
22、透明质酸酶活性是指酶催化透明质酸裂解的能力。美国药典(usp)提供透明质酸酶的测量法,其中透明质酸酶活性可通过如下方式间接确定:在使得酶与ha在37℃下反应30分钟后,测量剩余的较高分子量透明质酸、或透明质酸素底物的量(参见usp xxii-nfxvii(1990)644-645united states pharmacopeia convention,inc,rockville,md.)。可在测定中使用参考标准溶液以确定任何透明质酸酶的相对活性(以单位计)。用于测定透明质酸酶(如rhuph20)的透明质酸酶活性的体外测定在本领域中是已知的,并且在本文有所描述。
23、本发明所述的“mm”具体为“mmol/l”。
24、可选地,所述抗氧化剂的浓度为约1mm-约50mm,优选为约5mm-约25mm,优选为约10mm-约20mm。
25、可选地,所述抗氧化剂选自抗坏血酸、甲硫氨酸、柠檬酸和酒石酸中的至少一种,优选为甲硫氨酸。
26、可选地,其中所述稳定剂的浓度为约5mm-约400mm,优选为约10-约350mm,优选为约50mm-约300mm,进一步优选为约100mm-约250mm。
27、可选地,其中所述稳定剂选自多羟基烃、二糖、多元醇及苯甲醇中的至少一种。
28、可选地,所述多羟基烃选自山梨糖醇、山露糖醇及甘油,所述二糖选自麦芽糖、乳糖、果糖、蔗糖及海藻糖。
29、可选地,所述稳定剂为选自蔗糖、海藻糖和山梨醇中的至少一种。
30、可选地,其中表面活性剂的浓度为约0.001%w/v-约20%w/v,优选为约0.004%w/v-约2%w/v,进一步优选为约0.004%w/v-约0.2%w/v,优选为约0.01%w/v-约0.2%w/v,更优选为约0.01%w/v、约0.02%w/v、约0.03%w/v、约0.04%w/v、约0.05%w/v、约0.06%w/v、约0.07%w/v、约0.08%w/v、约0.09%w/v、约0.10%w/v、约0.11%w/v、约0.12%w/v、约0.13%w/v、约0.14%w/v、约0.15%w/v、约0.16%w/v、约0.17%w/v、约0.18%w/v、约0.19%w/v、约0.2%w/v。
31、可选地,其中表面活性剂选自聚山梨酯80、聚山梨酯20、泊洛沙姆、丙二醇、triton、聚乙二醇3350和十二烷基硫酸钠中的至少一种;优选为聚山梨酯80或聚山梨酯20。
32、其中,聚山梨酯20和聚山梨酯80的区别主要在于脂肪酸侧链的结构,脂肪酸侧链长度及饱和程度不同导致聚山梨酯与蛋白的亲和度不同。有机共溶剂的加入,降低了搅动、摇晃、冻融及冻干过程中蛋白的聚集,且起到了防止蛋白被吸附到容器表面的作用。
33、对于同一种聚山梨酯而言,其稳定蛋白的能力与其浓度有关,发明人发现发现在特定制剂配方中聚山梨酯(例如聚山梨酯20)达到一定浓度时能够抑制由晃动所引起的蛋白聚集,低于该浓度的聚山梨酯20则不能降低由摇晃所引起的蛋白不稳定(参见重组单克隆抗体药物制剂处方的作用及相关审评要点,邱晓,罗建辉,中国新药杂志2019年第28卷第16期)。
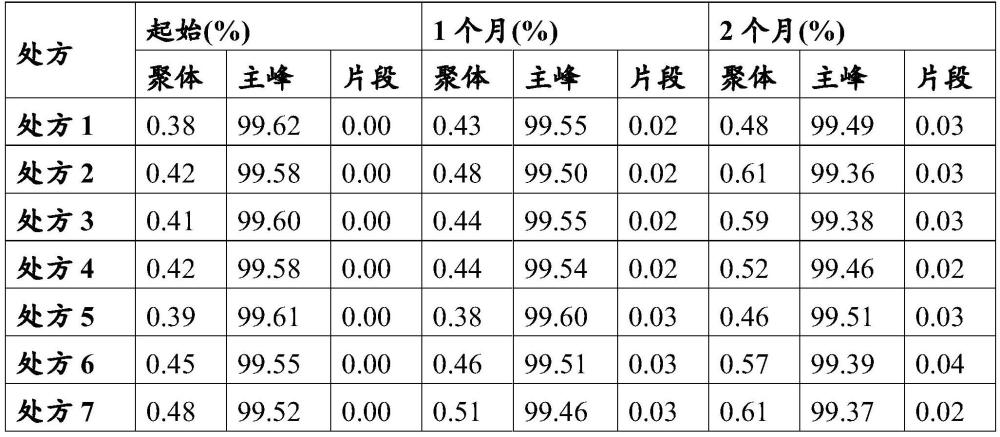
34、可选地,其中所述制剂具有为约4.0-约7.0ph值,优选为约5.0-约7.0ph值,优选为约6.0-7.0的ph值,进一步优选为约6.1-6.9的ph值更进一步优选为约6.3-约6.5的ph值。
35、可选地,其中所述缓冲液选自谷氨酸盐缓冲液、乙酸盐缓冲液、组氨酸缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液、硼酸缓冲液、tris缓冲液或hepes缓冲液中的至少一种,优选地为谷氨酸盐缓冲液、组氨酸缓冲液、乙酸盐缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液中的至少一种。
36、可选地,所述缓冲液的浓度为约0.05mm-约50mm,优选为约1.0mm-约30mm。
37、可选地,其中所述缓冲液选自谷氨酸盐缓冲液、乙酸盐缓冲液、组氨酸缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液、硼酸缓冲液、tris缓冲液或hepes缓冲液中的两种。
38、可选地,所述制剂第一种缓冲液为25mmol/l-50mmol/l的组氨酸盐,第二缓冲液为25mmol/l-50mmol/l的柠檬酸盐或醋酸盐。
39、可选地,其中所述粘度下降剂选自精氨酸、组氨酸、丙氨酸、甘氨酸、谷氨酸、脯氨酸或赖氨酸中的至少一种。
40、可选地,所述粘度下降剂的浓度为约1mm-约250mm,优选为约5mm-约200mm,更优选为约10mm、约15mm、约20mm、约25mm、约30mm、约35mm、约40mm、约45mm、约50mm、约55mm、约60mm、约65mm、约70mm、约75mm、约80mm、约85mm、约90mm、约95mm、约100mm、约105mm、约110mm、约115mm、约120mm、约121mm、约122mm、约123mm、约124mm、约125mm、约126mm、约127mm、约128mm、约129mm、约130mm、约131mm、约132mm、约133mm、约134mm、约135mm、约136mm、约137mm、约138mm、约139mm、约140mm、约145mm、约150mm、约155mm、约160mm、约165mm、约170mm、约175mm、约180mm、约185mm、约195mm、约200mm。
41、本发明还提供了一种稳定的药物制剂,其中经尺寸排阻色谱法确定,在4℃储存8周后,至少存在99.0%的单体形式的抗体。
42、本发明还提供了一种稳定的药物制剂,其中经尺寸排阻色谱法确定,在25℃储存20周后,至少存在95.5%的单体形式的抗体。
43、本发明还提供了一种稳定的药物制剂,其中经尺寸排阻色谱法确定,在40℃储存8周后,至少存在95.5%的单体形式的抗体。
44、本发明还提供了一种稳定的药物制剂,其中经尺寸排阻色谱法确定,在40℃储存14周后,至少存在90.0%的单体形式的抗体。
45、本发明还提供了一种稳定的药物制剂,其包含:
46、约50mg/ml-约170mg/ml的抗α4β7抗体,所述抗体包含seq id no:7的重链可变区和seq id no:8的轻链可变区;
47、约1000u/ml-约10000u/ml透明质酸酶;和/或
48、约0.05mm-约50mm的柠檬酸盐缓冲液和/或组氨酸缓冲液;和/或
49、约0.001%w/v-约20%w/v的吐温20或吐温80;和/或
50、约1mm-约200mm的精氨酸和/或组氨酸;
51、所述制剂具有约5.0-约7.0的ph。
52、本发明还提供了一种稳定的药物制剂,其包含:
53、约50mg/ml-约170mg/ml的抗α4β7抗体,所述抗体包含seq id no:7的重链可变区和seq id no:8的轻链可变区;
54、约1000u/ml-约10000u/ml透明质酸酶;
55、约10mm-约25mm的柠檬酸盐缓冲液或组氨酸缓冲液;和/或
56、约0.005%w/v-约0.2%w/v的吐温20或吐温80;和/或
57、约5mm-约25mm的精氨酸和/或组氨酸;
58、所述制剂具有约6.0-约7.0的ph。
59、本发明还提供了一种稳定的药物制剂,其包含:
60、约160mg/ml的α4β7抗体,所述抗体包含seq id no:7的重链可变区和seq id no:8的轻链可变区;
61、约1000u/ml-约10000u/ml透明质酸酶;
62、约50mm的组氨酸缓冲液;
63、约25mm的柠檬酸盐缓冲液或25mm的醋酸盐缓冲液
64、约0.01%w/v-约0.2%w/v的吐温20或吐温80;和/或
65、约100mm-约150mm的精氨酸和/或组氨酸;
66、所述制剂具有约6.5的ph。
67、本发明第二方面提供了一种容器,其包含第一方面任一项所述的稳定的液体药物制剂。
68、可选地,所述容器为管、瓶子(如西林瓶)、小瓶或注射器。
69、本发明第三方面提供了一种药盒,其包含第二方面所述的容器和用于输注所述制剂的装置。
70、本发明第四方面提供了第一方面中任一项所述的药物制剂在制备用抗α4β7抗体治疗的相关疾病的药物中的用途。
71、本发明还提供了第一方面中任一项所述的药物制剂,其用于治疗适合用抗α4β7抗体治疗的相关疾病。
72、本发明还提供了一种治疗α4β7相关疾病的方法,包括施用治疗有效量的第一方面中任一项所述的制剂。
73、术语
74、在本技术中,当涉及具体列举的数值或数值范围时,本文使用的术语“约”或“大约”通常意指给定的值或范围的20%内、优选10%内、更优选5%内。
75、术语“α4β7”或“α4β7整合素””意指α4链(cd49d,itga4)与β7链(itgb7)的杂二聚体。
76、术语“抗α4β7抗体”意指与人α4β7特异性结合的人抗体或其抗原结合片段。
77、术语“抗体”通常是指包含通过二硫键互相连接的四个多肽链即两个重(h)链和两个轻(l)链的免疫球蛋白分子,及其多聚体(例如,igm);然而,仅由重链组成(即,缺乏轻链)的免疫球蛋白分子也包含在术语“抗体”的定义之内。每一重链包含重链可变区(本文简写为hcvr或vh)和重链恒定区。重链恒定区包含三个结构域:ch1、ch2和ch3。每一轻链包含轻链可变区(本文简写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域(cl1)。vh和vl区可进一步细分为高可变区,称为互补决定区(cdr),其与称为框架区(fr)的更保守的区域互相交替。每一个vh和vl包含3个cdr和4个fr,从氨基端至羧基端以以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
78、除非特别另外指出,本文所用术语“抗体”以最广义使用,是指并包括免疫球蛋白分子,具体包括单克隆抗体,抗原结合片段,双特异性、多异性抗体,二聚、四聚或多聚抗体,单链抗体、结构域抗体,以及包含具有所需特异性的抗原结合位点的免疫球蛋白分子的任何其它经修饰构型,只要它们展现出期望的生物学活性。
79、术语“单抗”是单克隆抗体的简称,是指基本上同质的抗体群体获得的抗体,即除了可以在单克隆抗体的生成期间生成的可能的变体(此变体一般以少量存在)外,构成群体的抗体个体相同和/或结合相同表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相反,每种单克隆抗体针对抗原上的单一决定簇。单克隆抗体可以是单价的、二价的或多价的。
80、透明质酸酶分为三大类,哺乳动物型透明质酸酶、细菌透明质酸酶、来自水蛭、其它寄生物和甲壳动物的透明质酸酶,其可自重组dna技术制造、人样品衍生或者动物组织提取。术语“rhuph20”是指重组人透明质酸酶rhuph20(seq id no:9),是一种人源化重组蛋白。
81、术语“药物制剂”是指含有一种或多种药用活性成分和多种赋形剂的组合,达到治疗患者且稳定储存,安全有效的效果。药用活性成分是指发挥治疗作用的抗体、化学分子、天然化合物等。
82、术语“赋形剂”广义上是指除了活性治疗成分之外的任何成分。赋形剂可以是惰性物质、无活性物质和/或非药物活性物质。
83、赋形剂可用于多种目的,例如作为载体、溶媒、稀释剂、片剂助剂、和/或用于改善给药、和/或活性物质的吸收。
84、药物活性成分与不同赋形剂的配制是本领域已知的,参见例如remington:thescience and practice of pharmacy(例如第19版(1995),和任何更新版本)。
85、赋形剂的非限制性实例是:溶剂、稀释剂、有机共溶剂、粘度下降剂、抗氧剂、缓冲剂、防腐剂、等渗剂、螯合剂和稳定剂。
86、术语“稳定”是指其中的所有蛋白质在预期的贮存温度,例如0-40℃贮存后基本上保留其物理、化学、生物学活性。制剂中的抗体在储存一定时间后没有保持100%的物理、化学、生物学活性,制剂也可是稳定的。在储存一定时间后,保持约90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%以上的抗体结构和功能,可以认为制剂是“稳定的”。
87、制剂的稳定性可通过多种参数指标进行测定。例如可以通过确定在给定温度下储存一段时间后,制剂中剩余的单体百分比来表征。单体的百分比可以通过尺寸排阻色谱法来确定。给定的温度可以选自4℃、25℃、37℃,稳定性的储存时间可以选自2周、6周、10周、12周、14周、16周等。通过尺寸排阻色谱法测得的单体的百分比超过90%、92%、95%、96%、97%、98%、99%,认为制剂是“稳定的”。
88、本发明提供包含本文提供的稳定药物制剂的容器。所述术语“容器”可为管、瓶、小瓶或注射器。在所述容器是注射器的实施方案中,所述容器还包括注射针。因此,本发明提供的容器包含用于单剂量给药或多剂量给药的稳定的液体制剂。
89、术语“药盒”可包含本文描述的药物制剂和用于给药的装置,例如可将药物制剂与用于给药的装置例如注射器、吸入器、量杯、滴管、或涂敷器一起包装。所述药物制剂可装填于上述定义的容器中。所述药盒可选地包含使用说明书,其包含剂量、给药方案和给药方式的说明书。
90、术语“有效量”指提供期望效果的量。在药用药物制剂的情况下,它是活性成分有效治疗患者中的疾病的量。有效量可以延长无进展存活,产生客观响应,增加总体存活时间,和/或改善一种或多种α4β7相关症状。
91、术语“α4β7相关疾病”或“用抗α4β7抗体治疗的相关疾病”可以为发炎疾病,包括与白细胞浸润胃肠道(包括肠管相关内皮)、其他粘膜组织或表达分子madcam的组织(例如肠管相关组织,如小肠和大肠固有层的微静脉);以及乳腺(例如泌乳性乳腺)相关的疾病。具体地,包括但不限于炎性肠病(ibd),如溃疡性结肠炎、克罗恩氏病、回肠炎、乳糜泻(celiacdisease)、非热带口炎性腹泻(nontropical sprue)、与血清阴性关节病相关的肠病、显微性或胶原性结肠炎、嗜酸性胃肠炎、或直肠结肠切除术和回肠肛门(ileoanal)吻合术后所致的囊炎(pouchitis)等。
92、本发明所获得的稳定的药物制剂出乎意料地具有如下的有益技术效果:一方面所获得的药物制剂在25℃下稳定6个月、7个月、8个月、9个月、10个月、11个月、12个月或更长时间,在37℃下稳定3个月、4个月、5个月、6个月或更长时间;另一方面所获得的药物制剂经动物模型验证,其可实现单次注射量至少2ml,有效地减少患者的皮下给药次数和给药时间。
- 还没有人留言评论。精彩留言会获得点赞!